K_A_R_K_U_L_K_A: Jako u 1 mg je tezke predikovat kolik se ztrati pri zpracovani, ale co zkusit nejakou variantu hydrazin ci hydrazin.hydratu. Dela se to originalne ve smesi MeOH/voda, ale nebal bych se zkusit smes EtOH ci iPrOH treba s THF.
Katalyza niklem je mozna, ale nejlepsi je FeCl3 na silikagelu.
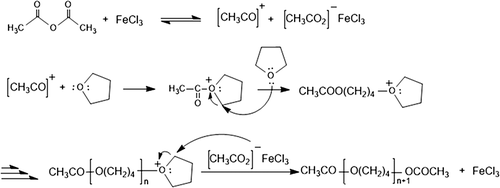
THF podleha otevreni kruhu a polymerizaci za katalyzy FeCl3, ale musi k tomu byt podminky (viz. obrazek). Kvuli hydrazinu nemuzes zase pouzit EtOAc.
Takze typicka procedura je ze rozmichas latku v MeOH (nebo te alternativni smesi rozpoustedel), pridas 5% FeCl3 na silikagelu, zahrejes (podle rozpoustedel, ale klidne treba na 70+°C). Opatrne pridas hydrazin.hydrat (klidne 10eq nebo i vic) a zahrivas, pripadne refluxujes hodiny nebo overnight.
Da se pouzit i Pd/C a hydrazin.